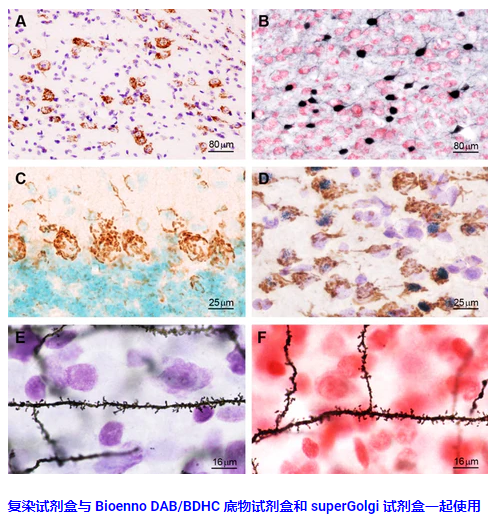
凝集素在组织化学、ELISA 和蛋白质印迹中的应用
组织化学:
1。石蜡切片染色程序:用二甲苯或其他清洗剂和分级酒精系列对组织切片进行脱蜡和水化,在自来水中冲洗5分钟。如果需要,检索抗原使用抗原揭膜溶液(柠檬酸盐为基础,Cat。不。H-3300或tris型,Cat。不。h – 3301)。1 b。冷冻切片染色程序:风干切片。染色前立即用丙酮固定切片。将片传输到缓冲区。如果内源性酶活性存在,用适当的方法灭活。
2. 如果需要,使用链亲和素/生物素阻断试剂盒(Cat)进行链亲和素/生物素阻断。不。sp – 2002)。Avidin/Biotin阻断试剂盒(Cat.;不。SP-2001)是一种含有末端甘露糖残基的糖蛋白。不建议使用亲和素/生物素阻断试剂盒,特别是当使用甘露糖特异性凝集素时。
3.用carbofree™阻断溶液(Cat)孵育片段阻断非特异性结合。不。SP-5040)在室温下放置30分钟。从切片上吸去多余的堵塞溶液。
4. 在PBS (10 mM磷酸钠,150 mM NaCl, pH 7.4)中加入约2-20 μg/ml的生物素化凝集素,在室温下孵育30分钟。用TPBS (PBS + 0.05% Tween®20)清洗。
5. 准备VECTASTAIN®Elite®ABC-HRP (Cat)。不。PK-6100)或VECTASTAIN®ABC-AP (Cat;不。根据试剂盒说明使用AK-5000)试剂。涂于切片上,室温孵育30分钟。用TPBS清洗。6. 为步骤5中使用的酶系统应用适当的沉淀底物。对于过氧化物酶,impact®DAB (Cat。不。SK-4105);用于碱性磷酸酶,impact®Vector®Red (Cat;不。推荐使用SK-5105)。用自来水冲洗。7. 防污(可选),清洁和安装。
ELISA:
1。将50-200 μl约3 μg/ml的糖蛋白溶液放入所需孔中,将目标蛋白吸附到微滴板上。有些井可能不进行处理,作为负控制。37℃孵育1小时。用TPBS (PBS + 0.05% Tween 20)洗涤孔3次。
2. 阻断非特异性结合,在室温下用无碳水化合物阻断溶液将每个孔填满30分钟。用TPBS洗三次井。在下面的程序中,试剂的体积为100 cm2膜的开发进行了优化。体积可以按比例调整不同大小的印迹。
3.在PBS中加入50-200 μl约2-20 μg/ml的生物素化凝集素,室温孵育30分钟。用TPBS洗三次井。
4. 根据试剂盒说明制备veectastain Elite ABC-HRP或veectastain ABC-AP试剂。涂于孔中,室温孵育30分钟。用TPBS洗三次井。
5. 为步骤4中使用的酶系统应用适当的非沉淀底物。对于过氧化物酶,TMB (Cat。不。推荐使用SK-4400)。6. 用分光光度法定量有色反应产物。
Western Blot:
1。根据标准程序进行电泳并将蛋白质转移到膜上。
2. 室温下,在无碳水化合物阻断溶液中培养30分钟,阻断非特异性结合。使用足够的体积来覆盖薄膜。
3.在含有约2-20 μg/ml生物素化凝集素的PBS中室温孵育膜30分钟。用TPBS (PBS + 0.05% Tween 20)洗涤。
4. 根据试剂盒说明制备veectastain Elite ABC-HRP或veectastain ABC-AP试剂。室温下将膜在试剂中孵育30分钟。用TPBS清洗。
5. 为步骤4中使用的酶系统应用适当的底物。对于过氧化物酶,DuoLuX®化学发光和荧光底物(过氧化物酶,Cat。不。SK-6604)或impact®DAB (Cat。不。sk – 4105)建议;碱性磷酸酶,化学发光和荧光底物(碱性磷酸酶,Cat。不。SK-6605)或BCIP/NBT(碱性磷酸酶,Cat。不。SK-5400)。仅供研究使用。不适用于动物或人类的治疗或诊断用途。
负控制:负控制应该在上述每种方法中并行运行,以验证绑定结果。当应用凝集素时,最合适的阴性对照之一是预先吸收凝集素与已知凝集素具有高亲和力的特定糖的浓度。Vector Laboratories提供了一系列用于这一目的的糖。将凝集素在含有约200 – 500mm糖的溶液中稀释到合适的工作浓度。该混合物在室温下结合30至60分钟。在吸收孵育之后,将混合物替换为未吸收的凝集素,并在相同条件下孵育。测试方法遵循后续检测程序。在大多数情况下,绝大多数凝集素结合到组织切片(膜印迹等)将被消除。在这些条件下,一些与切片的痕量结合(印迹等)可能仍然存在,并且可能表明存在二级或三级糖偏好。这些阴性对照结果应与试验结果进行比较,以确定结合的特异性。