内毒素污染对基因治疗和细胞治疗的影响

基因疗法正在彻底改变我们治疗人类疾病的方式。任何通过修改个人基因来治疗或治愈疾病的技术都被认为是基因疗法的形式之一。这些技术可以通过几种潜在的机理实现。一个基因的致病之处可能被灭活,或被健康的版本所取代,又或者是引进一个新的基因来对抗一种疾病。基因治疗产品是通过将遗传物质引入细胞核而发挥作用的。为了引入遗传物质,科学家需要一个可将基因、核酸酶或短发夹RNA(shRNA)运送到人体细胞核的运输系统。携带这种遗传物质的运输工具被称为载体1。
应用于基因治疗的载体多种多样,可分为病毒型和非病毒型。病毒载体是目前美国食品和药物管理局(FDA)批准的基因疗法中使用的载体,而非病毒技术作为一种安全有效地将遗传物质运送给细胞以达到治疗效果的方法正在研究当中1。但与非病毒载体相比,病毒载体的基因转移效率高10倍至1000倍。然而我们应该意识到,基于非病毒载体的基因疗法安全水平高且生产成本低,具有非常高的吸引力,在未来的药物开发中具有很大的潜力5。
目前最常见的两种载体是质粒和病毒。质粒是细胞内的一种小型染色体外DNA分子,与染色体DNA物理分离,可以独立复制。最常以小型环状双链DNA分子的形式出现在细菌中,但有时也会出现在古细菌和真核生物中。在自然界中发现的质粒,往往携带着有利于生物体生存的基因,并能提供独特的优势,例如对抗生素的强烈抗性。染色体很大,并且含有在“正常条件“下生活的全部基本遗传信息,而质粒通常很小,只含有在某些压力、逆境或疾病状态下才可能发挥作用的额外基因2。另一方面,由病毒载体包装的基因可以整合到宿主细胞的基因组中并永久表达。一些类型的病毒可将其基因组插入宿主的细胞质中,但实际上并没有进入细胞,而另一些病毒会伪装成可穿透细胞膜的蛋白分子,进而很容易地进入细胞。可能发生的病毒性感染主要有两种类型,一种被称为裂解性感染,另一种为溶源性感染。裂解循环的病毒在插入其DNA后不久就迅速产生更多的病毒,随后从细胞中迸发出来,继续感染越来越多的细胞。溶源性病毒则是将其DNA整合至宿主细胞的DNA后,在对某个触发因素作出反应前可在体内存活多年。病毒会像细胞一样繁殖,并且不会对所依赖的宿主造成任何伤害,直至被某种方式触发。一旦被触发,病毒就会从宿主的DNA中释放出来,以此创造新的病毒3。
最早应用于基因治疗的病毒载体是以腺病毒为基础的,腺病毒会引起普通感冒以及人类呼吸道、肠道和眼部感染1。腺病毒以双链DNA的形式携带遗传物质。当进入宿主细胞时,这种遗传物质可短暂存在于细胞核中,因此能够像其他基因一样自由进行转录。并且,人们发现腺病毒会在患者体内引发强烈的、具有潜在危险的免疫反应,因此,使用该类型病毒进行基因治疗的研究仍在继续3。逆转录病毒、单纯疱疹病毒等其他病毒载体也已被使用。
基因治疗产品与所有人体治疗药物一样,关键在于不受内毒素污染。内毒素,也被称为脂多糖(lipopolysaccharide)或LPS,是革兰氏阴性细菌外细胞膜的一种成分。作为一种极强的热原,微量接触也会导致危险的发烧甚至败血症。此外,内毒素具有高度的耐热性,很难通过传统的方法来清除。
根据FDA管理指南,所有静脉注射药品的内毒素含量必须低于5 EU每公斤体重。但内毒素普遍存在于环境,实验室也不例外,因此,基因治疗产品在用于人体测试前进行内毒素污染测试是至关重要的。
2019年发表于《Molecular Therapy – Methods & Clinical Development 》的一篇论文测试了一种从重组腺相关病毒(rAAV,一种常见的基因治疗载体)原液中去除内毒素污染的新方法。大肠杆菌通常是内毒素污染的来源,rAAV便是由大肠杆菌中分离出来的质粒DNA制备而来。8
该作者使用LAL(美洲鲎试剂)检测法来定量内毒素水平。清除rAAV原液的挑战之一是任何残留的洗涤剂都会引起毒性,还会干扰LAL检测试剂,从而导致假阴性。其原因在于掩蔽效应,即脂多糖分子被洗涤剂分子包围,无法与LAL试剂相互作用。因此,作者将洗净原液中的洗涤剂水平保持在临界值以下,以便于使用LAL精准地检测内毒素。8
这项研究强调了彻底净化基因治疗产品的重要性,以及为了去除残留的洗涤剂而进行严格的交换缓冲液冲洗的必要性。随着基因治疗的普及,科学家们仍须意识到内毒素污染潜在危险的重要性,以及需要避免由于洗涤剂残留而造成假阴性结果。8
与基于基因疗法的治疗方法一样,细胞治疗产品也需要考虑可能受到污染的问题。细胞治疗产品包括细胞免疫疗法、癌症疫苗和应用于某些治疗适应症的其他类型自体或异体细胞,如造血干细胞和成人及胚胎干细胞。基因治疗是通过蛋白载体或载体将遗传物质转移到合适的细胞中,而细胞治疗是将具有相关和必要功能的细胞转移到患者体内。4,6
在实验室环境中培养任何一种类型的细胞时,所面临的首要问题始终是避免污染。生物污染往往是工作的重点,同时也是最容易检测和避免的。
例如,大多数细菌或真菌污染在细胞培养基中肉眼可见,并可以使用抗生素处理来预防。而支原体或其他细胞系等其他生物污染物则更难检出,但仍可通过市面上的检测试剂盒进行检测。
化学污染与生物污染相比,受到的关注相对较少,并且更难检测和避免。其中,最隐蔽的化学污染物就是内毒素。潜在的内毒素污染源包括水、细胞培养基、血清、玻璃制品和塑料制品。正如本文在基因治疗产品部分中所提及,细胞治疗中发现的内毒素对高压灭菌和辐照都有很强的耐受力,这意味着它们可以在没有活细菌的情况下存在。其高疏水性也使其对塑料制品具有很强的亲和力,而且内毒素与活细菌不同,在细胞培养基无法通过肉眼确认。此外,内毒素不能用抗生素去除,需要使用专门的内毒素清除溶液。
采取措施避免内毒素引起的细胞培养问题,可以使研究人员对实验结果更有信心。为了帮助保持细胞培养物及其产生的疗法不受内毒素的污染,人们已提出了多种解决方法。其中,包括使用高纯度的水和低内毒素的FBS,以及使用经认证为无内毒素的塑料器皿。7 然而,除了使用纯化的原材料和试剂外,建立强大的无菌技术和灭菌程序,对减少内毒素污染的几率而言也非常重要。
无菌技术是每一位生物研究人员必备的核心技能之一。为避免出现实验伪像和潜在的细胞死亡,有必要防止细胞培养物的污染。此外,动物研究中的污染也可能导致感染或死亡。
大多数生物污染物可以使用漂白剂或乙醇等标准的消毒试剂来避免,但内毒素高度稳定,在没有活菌的情况下也能继续存在。因此,对于质控技术人员来说,保持严格的无菌技术标准操作程序至关重要。
定期更换手套是内毒素相关无菌技术的示例之一。没有经验的细胞培养技术员可能认为经常用乙醇喷洒手套就足以保持无菌状态,但乙醇可能会带来内毒素污染,因此,应为使用者制定更换手套的频率标准。

内毒素污染会极大地影响体外实验,特别是涉及免疫细胞的实验。巨噬细胞对内毒素的反应表现为IL-6分泌增加,而T细胞的表现为增殖和淋巴因子的产生增加。
受到内毒素的影响,非免疫细胞也可能会失调。传统上认为内毒素是通过CD14受体起作用的,但缺乏这种受体的细胞仍可对内毒素污染表现出强烈的反应。例如,一项研究报告指出,心肌细胞在暴露于内毒素时,会出现收缩功能障碍。其他研究也报告了CHO细胞内蛋白产生的改变以及输尿管上皮细胞中克隆效率的改变。
此外,不同的细胞系对内毒素污染的灵敏程度差异巨大。一些细胞系在内毒素低于1 ng/mL的情况下即表现失调,而其他细胞系则需要高达5000 ng/mL的浓度。也有理论认为,在培养中生长多年的细胞系(如HeLa和CHO细胞)可能随着时间的推移被自然选择为耐内毒素。基于这一点,很难确定一个广泛适用的内毒素污染安全阈值。
进行细胞培养时,购买低含量内毒素产品是至关重要的。然而,内毒素污染可能在打开试剂后产生,或在玻璃器皿/塑料器皿中转移污染,因此定期进行内毒素检测显得十分重要。
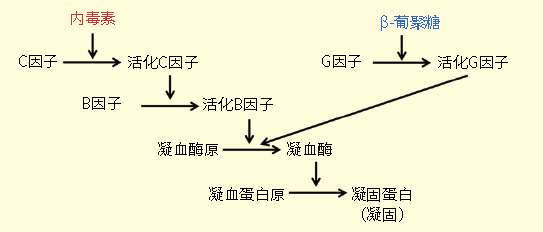
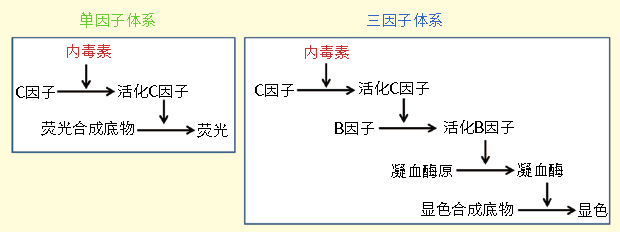
对于基因治疗和细胞治疗产品来说,鲎试剂(LAL)检测法为量化内毒素水平提供了一个兼具成本效益和高灵敏度的选择。本检测法依赖于从鲎血液中提取的蛋白,这些蛋白在内毒素存在的情况下发生凝结反应,可以对其定量以获取高度准确的内毒素水平读数。在维护我们的基因和细胞治疗的安全性方面,特别是应用于大规模生产以及重要的体外实验时,这种检测方法将会继续发挥关键作用。
◆相关产品
点击此处查看相关产品:内毒素检测系统Toxinometer® ET-7000
点击此处查看相关产品:PYROSTAR™ ES-F 系列鲎试剂
◆参考文献
|
1.
|
‘How Does Gene Therapy Work?’ (2020 June). Genehome. Available at URL: https://www. thegenehome.com/how-does-gene-therapywork/vectors?gclid=Cj߿KCQjwkZiFBhD9ARIsA GxFX8C5ࠂpUEumd-W8ࠁHmYSL_5gBGNPtMMD rR_882PILGN_0n9vF8icjPboaAjA-EALw_wcB
|
|
2.
|
‘Plasmid’. (2021 May 6). Wikipedia. Available at https://en.wikipedia.org/wiki/Plasmid
|
|
3.
|
‘Vectors in Gene Therapy’. (2020 December 16). Wikipedia. Available at URL: https:// en.wikipedia.org/wiki/Vectors_in_gene_ therapy
|
|
4.
|
‘Cellular and Gene Therapy Products’. (2021 March 2). U.S. Food and Drug Administration. Available at URL:https://www.fda.gov/vaccines-blood-biologics/cellular-genetherapy-products#:~:text=Cellular%20therapy%20products%20include%20cellular,adult%20and%20embryonic%20 stem%20cells
|
|
5.
|
Lundstrom, K. (2019). “Gene Therapy Today and Tomorrow”. National Center for Biotechnology Information, ‘Diseases’. Published online 2019 April 28. Available at URL: https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC6631424/
|
|
6.
|
David, A., Professor. “How Cell Therapy differs from Gene Therapy”. Future Learn. Available at URL: https://www.futurelearn. com/info/courses/making-babies/0/ steps/23934#:~:text=Whereas%20gene%20 therapy%20involves%20the,appropriate%20 cells%20of%20the%20body.
|
|
7.
|
Easthope, E. (2020). “Five Easy Ways to Keep Your Cell Cultures Endotoxin-Free”. Biocompare, published online 2020 April 20. Available at URL: https://www.biocompare. com/Bench-Tips/563017-Five-Easy-Ways-toKeep-Your-Cell-Cultures-Endotoxin-Free/
|
|
8.
|
‘Removal of Endotoxin from rAAV Samples Using a Simple Detergent-Based Protocol’. (2019 December 13). Molecular TherapyMethods & Clinical Development, published online 2019 September 6. Available at URL: https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC6804492/
|
 Lisa Komski
Lisa Komski
Lisa Komski是FUJIFILM Wako Chemicals U.S.A. Corporation LAL部门的销售总经理。在化学和生命科学行业拥有近30年的职业生涯,是美国食品和药物管理局(FDA)要求和cGMP方面的业务发展专业人士。Lisa拥有生物学和医学技术学位。
Email:lisa.komski@fujifilm.com
※ 本页面产品仅供研究用,研究以外不可使用。