肽-药物偶联物(PDC):发展现状及研究进展
靶向抗癌药物一直是近年来药物研发的热点。随着抗体-药物偶联物(ADC)的成功,新型偶联药物不断涌现,如肽-药物偶联物(PDC)、放射性核素药物偶联物(RDC)、抗体-寡核苷酸偶联物(AOC)等。
目前,大多数新的缀合药物仍处于早期阶段,而PDC有相对较多的产品处于临床开发阶段,有望成为继ADC之后的另一个热点领域。
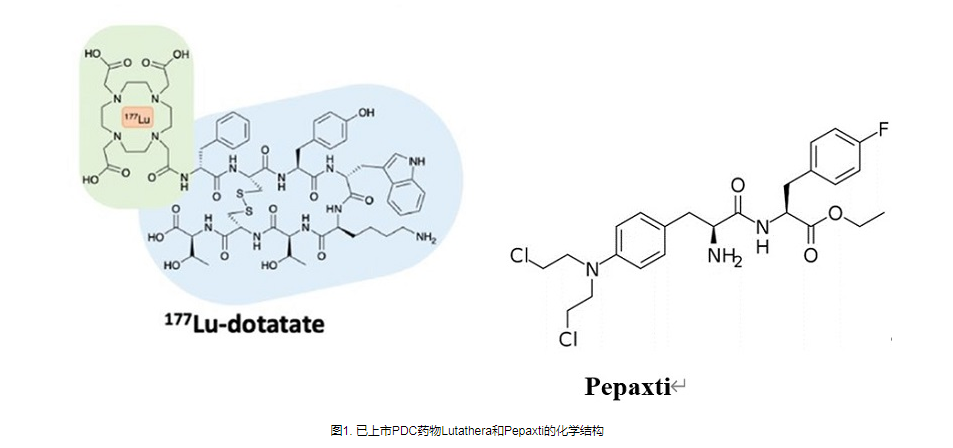
肽-药物偶联物(PDC)是继抗体-药物偶联物(ADC)之后的下一代靶向治疗药物,其核心优势是增强细胞通透性和提高药物选择性。截至目前,全球已有两款PDC药物获批上市,分别是诺华公司2018年开发的Lutathera和Oncopeptipes公司2021年开发的Pepaxto。
与ADC药物相比,PDC药物具有分子量小、肿瘤穿透性强、免疫原性低、生产成本低等优点。 PDC药物有望成为继小分子药物、单克隆抗体、ADC药物之后的新一代靶向抗癌药物。过去几年,多家制药公司一直致力于开发 PDC 药物,作为癌症、代谢性疾病等疾病的靶向治疗候选药物。本文介绍了PDC药物的发展现状及未来发展方向,希望为PDC药物研发带来参考价值。
ADC 和 PDC 的比较
肽在人类生命中发挥着多种功能,如修复细胞、改善细胞代谢、防止细胞变性等。肽具有生物活性和良好的靶向转运能力。这一特性使其不仅适用于肿瘤学,还适用于糖尿病、风湿病和类风湿关节炎的靶向治疗。
PDC的结构与ADC类似,不同之处在于靶向单元。 ADC的靶向单元是抗体,而PDC是肽(图1)。PDC主要由多肽、链接链和细胞毒素组成。 PDC的作用机制也与ADC类似。靶向多肽与细胞毒素通过细胞内可分解的连接链共价连接,精准靶向肿瘤细胞的特异性受体,可控释放细胞毒素,从而杀伤肿瘤细胞。 PDC的分子量较小,因此表现出更好的膜渗透性。同时,PDC更容易被肾脏清除和代谢,这对于减少对肝脏和骨组织的毒性至关重要。此外,PDC的生产成本较低,载药量种类较多。因此,PDC是一种具有巨大研发前景和市场前景的靶向治疗药物。

图 2. PDC 和 ADC 的比较
研究表明,PDC药物比 ADC药物有更广泛的应用。除了癌症治疗之外, PDCs还可以应用于许多其他疾病,作为抗癌药物递送的一种手段,PDC 具有共价修饰配体肽的优势,可以靶向肿瘤部位的特定细胞表面受体或生物标志物,以获得持久的疗效,从而赋予总体理想的药代动力学特征。这使得足够数量的药物能够被输送到癌症部位,同时最大限度地减少对健康组织的暴露并降低毒性。
癌症是一个重大的公共卫生问题。根据患者的分期和肿瘤类型,患者接受以下一种或多种治疗:手术、放射治疗或化疗。 2019年底以来,随着病毒大流行席卷全球,许多新的药物治疗策略应运而生。但药物治疗存在不同程度的毒副作用,有些严重的毒副作用是限制药物剂量或使用的直接原因。
通常,化疗会迅速抑制细胞有丝分裂,并产生严重的副作用。即使肿瘤被成功除,健康组织也可能会受到化疗的影响。幸运的是,靶向药物治疗可以有效区分肿瘤细胞的特征(包括细胞pH、细胞GSH含量、细胞形态和酶表达差异),从而改善患者不良预后并减少毒性。作为一种新兴的靶向抗癌疗法,PDC 可驱动肿瘤干细胞中有毒有效负载的积累,从而实现精确的药物治疗。然而,PDC药物面临的最大挑战是其体内转运不稳定,导致生物利用度低。
PDC的重要组成部分
PDC是一种结构和功能与ADC相似的靶向治疗药物,由不同类型的肽与药物连接而成。PDC由三个重要成分组成:归巢肽、连接链和细胞毒su药物。这三种成分协同作用,通过靶向肿瘤细胞上的受体来递送化疗药物,以放大其治疗效果。
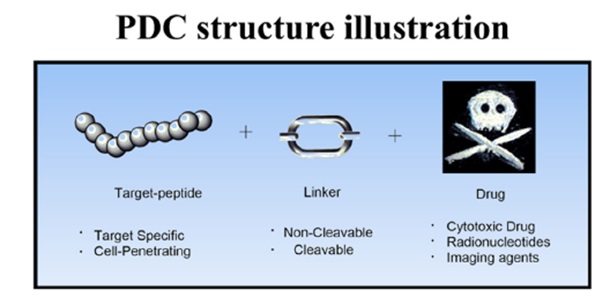
图3 PDC结构示意图
1. 归巢肽
PDC中的肽主要是细胞穿透肽(CPP)和细胞靶向肽(CTP)。目前,细胞穿膜肽在细胞膜上的摄取机制尚不清楚,细胞特异性较低,限制了细胞穿膜肽的应用。相反,细胞靶向肽是理想的载体,可以特异性结合肿瘤细胞表面受体(图3)并转运药物。常见的细胞靶向肽包括:铃蟾肽类似物、GnRH类似物、生长激素抑制类似物、RGD肽、PEGA等。
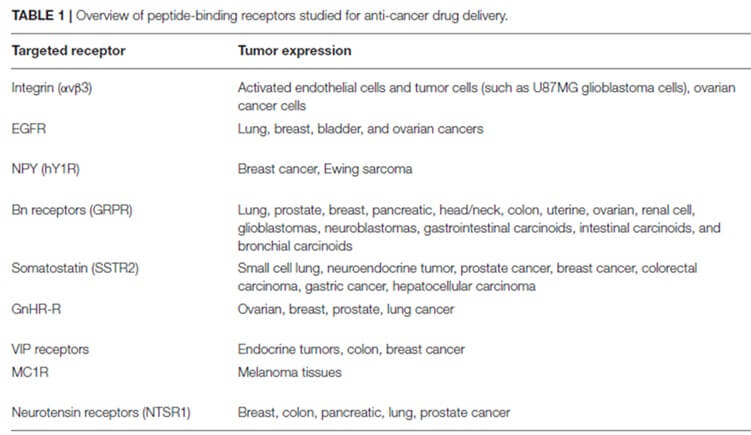
图 4. 常见的肽靶向受体
(1).靶向肽的选择
研究表明,不同的肽会影响PDC内吞药物的效率,并对疗效、药代/药效特征、治疗指标产生显着影响。一般来说,理想的PDCs肽应具有较强的靶点结合亲和力、高稳定性、低免疫原性、高效内化和长血浆半衰期。归巢肽可以靶向肿瘤组织中特定的过表达蛋白受体,直接将药物递送至靶细胞并限制化疗药物的脱靶递送。这些归巢肽通常在纳摩尔浓度下对靶标具有高结合亲和力。
此外,归巢肽的二级结构显着影响其结合亲和力。研究发现,连接链可以通过稳定二级结构来提高归巢肽与靶标的结合亲和力。除了靶向特性外,一些肽还可以充当细胞穿透肽(CPP),其表现出疏水性、两亲性和促进跨膜渗透的负电荷等特性。细胞穿透肽可以将药物递送至靶组织并介导细胞内的药物内化。然而,带正电荷的 CPP 有一些缺点,例如目标选择性不稳定,导致非特异性细胞摄取。因此,带负电荷的 cpp 常用于 PDC 中以提高肿瘤细胞特异性。
肽和小分子具有显着不同的药代动力学特性。其中,多肽药物的最大缺点是生物利用度和药物摄取较低,而且多肽通常不能口服。因此,快速的肾脏清除和短的半衰期阻碍了肽的体内研究以及影响其药物形成特性的因素。有多种方法可以改善肽的 ADMTE 特性:
A。增加细胞通透性。
b.增强化学稳定性和抗蛋白水解能力。
C。降低肾清除率,延长循环半衰期。
(2)。提高肽稳定性和细胞通透性的策略
目前,常见的提高肽稳定性和细胞通透性的策略主要包括以下几种(图4):
A。肽的环状修饰。环化反应广泛应用于多肽的合成中,包括头尾环化、头尾环化、侧链环化、侧链与侧链环化等。肽吻合常用于确定肽的二级结构,如α螺旋和β折叠,可以提高肽与其靶标的结合亲和力,提高其ADME。
b.氨基酸修饰。增加肽稳定性的另一种方法是使用 D-构型氨基酸代替 L-构型氨基酸。这降低了蛋白水解酶的氨基酸序列、底物识别和结合亲和力。
C。与化学大分子结合的修饰。肽的电荷与肾清除率相关。带负电荷的肽比带正电荷的肽具有更长的半衰期。较高分子量(>450 kDa)的肽可以增加肽的亲脂性。此外,PEG链修饰、PSA修饰、HES修饰、脂肪链修饰等修饰方法也可以增加多肽的半衰期。
d.改变剂型。细胞内蛋白质递送系统通常依赖于遗传蛋白质与基于阳离子脂质体、聚合物和无机纳米材料的膜穿透标签和蛋白质封装载体的融合。已报道了几种通过剂型提高肽治疗药物口服生物利用度的方法,例如添加渗透促进剂和耐酸包衣等。
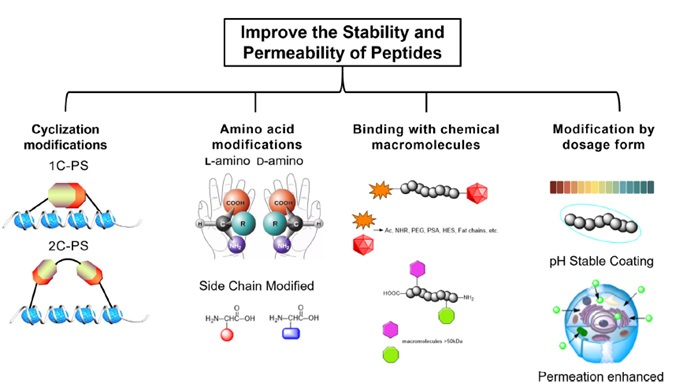
图5 肽的修饰策略
2. 连接链
连接链的选择是PDC设计的关键因素之一。需要考虑PDC的微环境,以免干扰肽与其受体的结合亲和力及药效。根据长度、稳定性、释放机制、官能团、亲水性/疏水性等特性,PDC 中使用不同类型的连接体。PDC 中使用的连接链必须表现出稳定性,以防止过早和非特异性药物释放。
连接链分为两大类:可裂解链和不可裂解链(图 5)。可裂解的连接链可以通过酶或化学方法裂解。其中,化学可裂解的连接链包括:PH敏感的连接链、二硫键连接链和外源刺激裂解的连接链。不可裂解的连接链不能被外部刺激激活,并且不可裂解的连接链在肽代谢释放有效负载后起作用。虽然可裂解接头在靶向治疗的开发中更有利,但不可裂解接头在体内代谢循环中更稳定。因此,可裂解或不可裂解接头的选择取决于靶向治疗剂的设计和作用模式的需要。
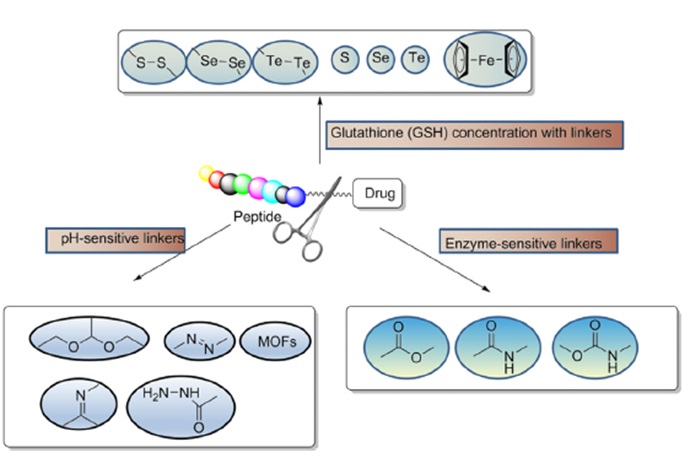
图 6. 环链的类型
3. 载药类型
有毒性药物是杀死肿瘤过程中重要的一部分。 PDC进入细胞后,毒素药物是最终导致靶细胞死亡的因素。因此,有毒性药物的毒性和理化性质可以直接影响药物杀伤肿瘤的能力,从而影响其疗效。一般来说,细胞毒素必须具备四个要求:作用机制明确、分子量小、细胞毒性高、与肽化学缀合后保留抗肿瘤活性。然而,每种有毒性药物通常都有其局限性,如PK性能较差等。此外,有毒性药物的非选择性是最大的缺点,会引起严重的副作用。由于化疗药物附着在肽上,因此需要较低的细胞毒性剂量。所以,所选的化疗药物通常具有较强的抗增殖活性。 PDC的化疗药物包括阿霉素、紫杉醇、喜树碱等。还包括放射性核素、177Lu装备。
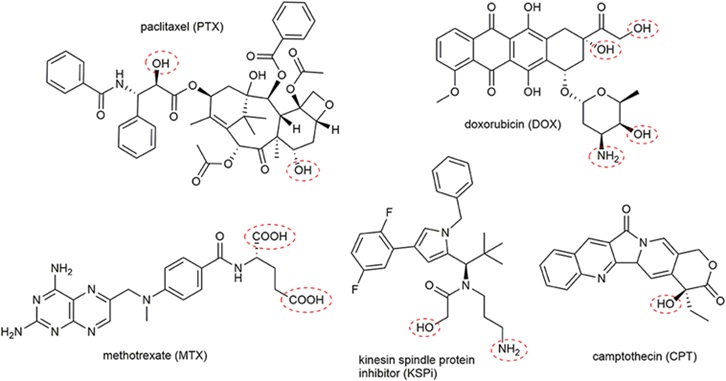
图 7. PDC 中的载药类型
PDC最新研究进展
迄今为止,全球已开发并上市两种PDC药物:Lutathera,由诺华于2018年批准,Pepaxto,由Oncopeptipes于2021年开发。Lutathera是诺华开发的第一个全球批准的PDC药物,属于新兴的肽受体放射性核素治疗(PRRT)。狭义上,该药物还可归类为放射性核素药物缀合物(RDC)。 Pepaxto是一种first-in-class肽缀合药物,严格来说,它是第一个获批的PDC药物。遗憾的是,同年10月22日,Oncopetides宣布撤回Pepaxto在美国市场,主要是因为在验证性III期OCEAN研究中,Pepaxto未能降低ITT人群的死亡风险。此外,还有多个PDC处于临床试验阶段,PDC赛道竞争激烈。
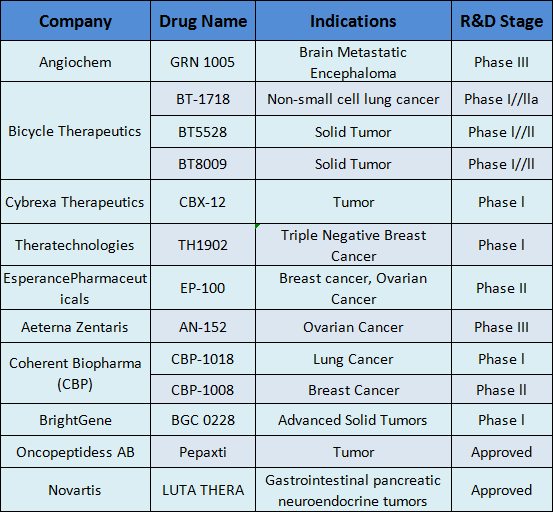
图8. 进入临床试验并获批上市的PDC药物
结论
PDC是多肽与化疗药物的组合,它结合了多肽的选择性和化疗药物的高抑制活性。 PDC通过修饰肽的氨基酸序列,可以改变缀合物的疏水性和电离性,解决水溶性和代谢差等问题,同时促进细胞通透性,有助于进一步的临床开发。此外,较低分子量的 PDC 更容易纯化。
PDC可以显着提高治疗效果,同时还可以降低毒性,提高治疗窗,在肿瘤治疗中具有更广阔的应用前景。尽管肽具有较小的分子量和更快的肾脏清除率,但这些问题已通过多种方法得到有效解决,包括化学修饰和物理技术(环化、结合肽、剂型)。
PDC是抗癌的一个新的研究领域,但仍存在许多问题有待解决。幸运的是,基于adc药物的成功研发,PDC研究或许可以有一些捷径,少走一些弯路。同时,随着研发技术的创新,PDC研究将逐步得到临床验证,从而推动该领域的发展,带来更多的治疗选择。
Biopharma PEG致力于成为您可靠的合作伙伴,提供各种PEG 连接体,以促进抗体药物偶联物 (ADC) 开发项目。我们致力于推动您的 ADC 发现和开发项目的进展。