免疫荧光染色实验步骤
免疫荧光染色是常用的生化检查方法,常用于组织学中抗原或抗体的定位,也可用于体液样本中抗原或抗体的定量检测。很多小伙伴在做免疫荧光染色实验时遇到了各种问题。其实,掌握了免疫荧光染色实验的原理、操作步骤和注意事项后,顺利完成一次免疫荧光染色实验并不困难。
1.什么是免疫荧光技术?
免疫荧光技术(Immunofluence technology)又称荧光抗体技术,主要原理是利用抗原与抗体之间的特异性结合来展示目标蛋白。免疫荧光技术不仅抗原抗体反应特异性高,而且在荧光显微镜下可以清晰显示其形态,直观性强。
免疫荧光染色实验有两种类型,包括直接免疫荧光和间接免疫荧光。
如何解决免疫荧光染色底色过重的问题?详细讲解实验操作及注意事项
直接免疫荧光是最早的方法。其基本原理是用已知的抗体标记荧光素,成为特异性荧光抗体。染色时,将抗体直接滴在载玻片上孵育,使其直接与载玻片上的抗原结合,可直接在荧光显微镜下检测。观察并做出判断。
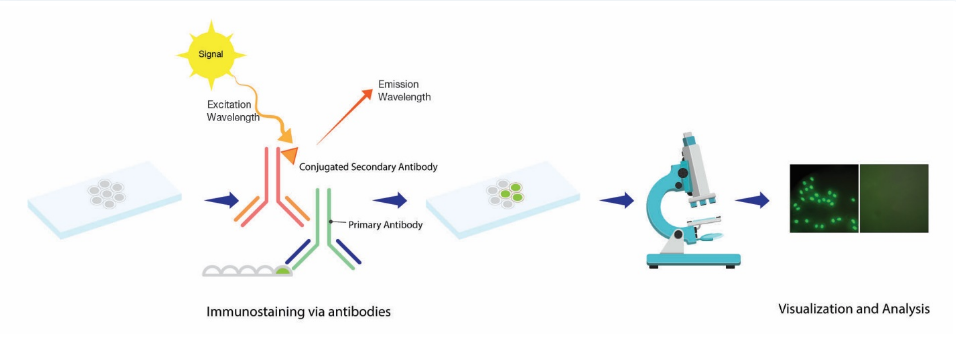
间接免疫荧光法的基本原理是利用特异性抗体与切片中的抗原结合,然后利用间接荧光抗体与之前的抗原抗体复合物结合,形成抗原抗体荧光复合物。在荧光显微镜下,通过复合物的发光来确定检测到的抗原。
两种方法的基本原理是相同的。免疫荧光 (IF) 或细胞成像技术使用抗体将荧光染料(也称为荧光素或荧光团)(例如异硫氰酸荧光素 (FITC))标记到特定的目标抗原。与荧光素化学缀合的抗体广泛用于 IF 实验。
直接免疫荧光法简单、特异、快速、方便,常用于肾活检组织中多种免疫球蛋白的检测和病原体的检测。但其缺点是只能检测一种相应物质,灵敏度较差,有时效果不理想。
间接免疫荧光法由于与抗原抗体复合物结合的荧光素抗体增多,荧光亮度强,因此具有较强的灵敏度。因此,间接免疫荧光法更为常用,只需制备一种荧光抗体,即可应用于多种一抗的标记展示。
2. 免疫荧光染色实验的操作步骤
免疫荧光染色的操作步骤通常包括:固定和透化、封闭、一抗孵育、洗涤、二抗孵育、重新洗涤和测定读数。本文以间接免疫荧光为例,讲解从固定到封固各步骤的原理。
1)样品制备
对于贴壁细胞:可以直接使用多孔板,如6孔板、24孔板等来培养细胞,然后在预定的时间进行固定等后续操作。也可以使用干净的盖玻片,浸泡在70%乙醇中,用无菌镊子置于6孔板中,然后用无菌盐水、PBS或培养基洗去残留的乙醇。此时即可接种细胞进行培养,待细胞在盖玻片上生长良好后,即可进行固定等后续操作。
对于悬浮细胞:先用固定液固定细胞,然后将细胞滴在载玻片上,干燥后细胞会粘在载玻片上。然后就可以进行后续操作了。如果细胞粘附力较差,可以用PDL等物质处理载玻片,以增强载玻片的粘附力。
对于冷冻切片:将切片放置在载玻片上后,可以直接进行固定等后续操作。
对于石蜡切片:将切片在二甲苯中脱蜡 5 分钟,然后用新鲜二甲苯脱蜡,并用共用二甲苯脱蜡 3 次。无水乙醇 5 分钟,两次。 90%乙醇5分钟,两次,70%乙醇5分钟,一次。蒸馏水5分钟,两次。
抗原修复:根据抗原和抗体的不同,可将切片放入以下抗原修复液中,10mM柠檬酸钠,pH6.0,或1mM EDTA,pH8.0,或10mM Tris,pH10.0,95℃加热12分钟,约30分钟慢慢冷却至室温。
2)固定
目标是保留组织的原始结构,维持细胞形态和抗原的细胞分布。当组织细胞死亡时,细胞会分解,从溶酶体和其他细胞器中释放的酶可以水解组织,这一过程称为自溶。为了避免这种情况,有必要固定组织细胞。
细胞或切片可以用适当的固定剂固定,固定后用免疫染色洗涤液 (P0106) 洗涤两次,每次 5 分钟。常用的固定剂有甲醛、戊二醛、甲醇/丙酮。不同固定剂所需的时间和浓度不同,需要根据具体实验探索。
3)膜破裂
膜破裂,使抗体有机会遇到抗原。因为免疫染色的基本原理是抗原和抗体结合,然后标记的抗体发出荧光,从而可以对目标蛋白进行定性或定量分析。如果待检测的抗原位于细胞膜或细胞外基质的外表面,则可以省略透化步骤。因为抗体也可以有机会与抗原结合而不破膜。然而,如果要检测的抗原位于细胞内,则需要打破细胞膜,并将细胞暴露于针对目标蛋白质的一抗,以确保抗体能够接近表位。常用的破膜剂有Triton X-100、NP-40、Brij-58、皂苷、洋地黄皂苷、甲醇/丙酮。再次,破膜剂的选择应根据具体实验进行。
4) 封闭
封闭是最小化一抗非特异性结合的重要步骤。在使用特异性一抗与目的蛋白结合的过程中,如果出现非特异性结合,可能会出现假阳性结果,而且背景染色过强也会干扰目的染色的呈现,影响对结果的判断。实验结果。理论上,任何不结合靶抗原的蛋白质都可以用于封闭。血清是一种常见的封闭剂,因为它含有与非特异性位点结合的抗体。使用血清或蛋白封闭剂进行封闭可防止抗体与组织或 Fc 受体的非特异性结合。
从封闭开始的所有步骤,必须注意样品的保湿,避免样品干燥,否则容易产生高背景。
5) 一抗孵育
预选的特异性一抗可以与目的蛋白结合。这一步需要注意一抗是针对什么物种的。如果组织细胞来源是小鼠,一抗应该是某种动物抗小鼠,其中某种动物是指一抗宿主,例如一抗是山羊抗小鼠,山羊就是一抗抗体宿主。
6)二抗孵育一
抗孵育后,将未结合的一抗洗掉,即可进行一抗与二抗的结合。二抗应该是针对一抗宿主物种的荧光标记二抗。例如,一抗是山羊抗小鼠,二抗应该是某种动物抗山羊,例如兔抗山羊。
如果进行双染,要注意一抗和二抗宿主的选择,以免出现交叉结合的可能。例如,如果组织来源是小鼠,并且需要检测两种目标蛋白,则一抗宿主应不同,二抗应具有不同的荧光标记。针对目标蛋白A的一抗可以是山羊抗小鼠,针对目标蛋白B的一抗可以是大鼠抗小鼠(大鼠和山羊是不同的一抗宿主),针对A的二抗是具有绿色荧光的兔抗体山羊二抗、B二抗是兔抗大鼠二抗,有红色荧光,这种组合是可以的。在荧光显微镜下,目标蛋白A被染成绿色,目标蛋白B被染成红色。但如果B一抗也是羊抗鼠的话,A二抗也会和B一抗结合,这时候就乱了,荧光镜下是绿色的。
7)盖玻片
封片是指免疫染色后使用封片剂将盖玻片粘附到组织切片或细胞涂片上。盖玻片可保护染色样本免受物理损坏。进行盖玻片的封片剂也有助于提高显微镜下图像的清晰度和对比度。
8) 蛋白质的检测
对于免疫荧光染色,此时已经可以直接在荧光显微镜下观察。
如何解决免疫荧光染色底色过重的问题?详细讲解实验操作及注意事项
3. 三种细胞免疫荧光染色实验举例
zo-1 的免疫荧光
1) 当细胞在盖玻片上生长至95%-100%汇合时从培养箱中取出。
2) 用预热的 1×PBS 洗涤 3 次,每次 10 分钟
3) 4% 甲醛室温固定 20-30 分钟
4) 用 1×PBS 洗涤 3 次,每次 10 分钟
5) 透化0.2% Triton X-100 2-5 分钟
6) 用 1×PBS 清洗 3 次,每次 10 分钟
7) 用 5% BSA 室温封闭 30 分钟
8) 添加一抗(用 1% BSA 稀释)放入潮湿盒中,4度过夜
9) 用1×PBS清洗3次,每次10分钟
10)加入二抗(1%BSA稀释)30分钟,关灯! !!
11) 用 1×PBS 清洗 3 次,每次 10 分钟
12) 用 95% 甘油封片
注:4% 甲醛、0.2% Triton、5% BSA 均用 1×PBS 稀释”
细胞载玻片的免疫荧光
1)取出细胞载玻片放入35mm或60mm用过的培养皿中,用PBS洗涤3次。
有时制作的细胞玻片可能比较小,所以挑取时要小心,注意反面,放在培养皿中清洗比较方便,避免来回剪切,清洗时加PBS,不要洗太多,不要冲洗细胞。洗的时候我总是多加一些PBS,稍微摇晃一下就倒掉,不用等5分钟或者10分钟。
2) 4%冷多聚甲醛固定20分钟,PBS洗涤3次。
3) 用0.2% Triton X-100 透化10 分钟,用PBS 洗涤3 次。
4)与二抗相同宿主的血清封闭30分钟,PBS洗涤3次。
5) 一抗可在湿化盒中4度保存过夜,或37度保存2小时。感觉前者有效。用 PBS 清洗 3 次。
6)二抗室温放置2小时(避光),或37度1个半小时,PBS洗3次。
7)最好用DAPI对细胞核进行染色,然后直接拍摄荧光胶片。
8) 用蒸馏水洗掉PBS,用甘油封膜,并用指甲油封膜周围。因为甘油不像树脂那样干燥,如果不用指甲油密封的话就会乱七八糟。
细胞免疫荧光简单实验
1)将血清蛋白H7.2-7.4在37度PBS中冲洗2小时。
2) -20度甲醇固定20分钟后,自然干燥10分钟
3) PBS清洗:3min*3
4) 1% Triton:25min-30min。配成50ultriton+5ml pBS
5) PBS洗:2*5min
6) 羊血清封闭:37度,20分钟
7) 一抗,4度过夜,一般18小时以上或37度1-2小时
8) 4度PBS洗,3min*5次
9)二抗37度不到一小时
10)37度PBS洗,干燥3*5min,密封(封闭液PH8.5)
无论采用何种方法,用PBS缓冲液漂洗时,必须漂洗干净,并测量pH值。可以用PBS清洗几次,也可以延长PBS清洗时间。如果结果背景较高,可以延长漂洗次数。和时间。
如何解决免疫荧光染色底色过重的问题?详细讲解实验操作及注意事项
四、免疫荧光染色注意事项
1)荧光试剂应妥善保管
尽管许多荧光团相对光稳定,但在储存和染色过程中未能避光可能会导致荧光团-抗体缀合物降解,从而导致假阴性结果。因此,荧光物质必须在建议的温度下小心储存,并始终避光,以保护其光谱完整性。
2) 仔细选择荧光 免疫荧光
技术的一个主要优点是它提供了多重检测的机会,如今流式细胞术可以测量每个细胞 20 多个离散参数。在设计多重实验时,应考虑每种荧光团的性质,例如吸收和发射最大波长、消光系数和斯托克斯位移。
3)适当的对照是必要的
任何实验数据的分析都依赖于相关的对照,免疫荧光染色也不例外。每次检测需设置以下三个对照:
(1) 阳性对照:阳性血清+荧光标记
(2) 阴性对照:阴性血清+荧光标记
(3) 荧光标记对照:PBS+荧光标记
5、免疫荧光实验常见问题排查指南
1)背景染色太强
背景染色太强,意味着除了我们希望看到的特异染色在前景中起主导作用外,还有一帮吃瓜群众(与我们想要看到的特定染色相同的颜色)在后面。
到底是什么原因导致这些演员抢了主角的戏呢?可能的原因如下。
组织切片太厚:这种情况,可以选择将组织切片变薄。
封闭不良:封闭的目的是减少非特异性结合,减少背景染色。如果背景太强,考虑更换封闭液或增加封闭孵育时间
二抗具有非特异性结合:要验证是否存在这种情况,可以制作空白对照,只在染色过程中添加二抗(也就是说一抗不要使用特异性一抗)孵育过程,例如使用一抗稀释液进行孵育一抗的步骤)。如果空白对照被染色,则表明二抗具有非特异性结合。此时,建议更换二抗。
自发荧光:要了解组织是否具有自发荧光,请在非染色区域寻找荧光。一些自发荧光来自固定步骤,可以避免戊二醛固定或用 PBS 中的 0.1% 硼氢hua钠清洗以去除游离醛基。还有一些来自内源性荧光分子的荧光,可以用苏丹黑/硫酸铜进行光漂白。
抗体浓度过高:降低所用抗体浓度或调整孵育时间。
洗涤不充分:染色的步骤较多,而洗涤的步骤也较多。实验过程中要确保洗涤到位,不要偷工减料。
2)染色弱或无染色
可能的原因有:您要研究的目的蛋白在组织本身中不存在或表达量很小。
如果怀疑目的蛋白不存在,可以通过WB等多种方法进行验证。由于不同蛋白质探索实验的原理和操作不同,结果可能会有所不同,多次实验的验证更容易避免假阴性。如果感兴趣的蛋白质表达量较小,则可以考虑采取额外的步骤来放大荧光信号。
荧光显微镜的问题。
如果荧光显微镜的参数设置不正确,可能看不到荧光。例如,光源/滤光装置与您想要检测的荧光不匹配。每次拍照时,记得检查参数是否正确。
曝光时间太短或光吸收太低(增益值太低):您可以尝试增加增益值和/或增加曝光时间以找到最佳值。
曝光时间过长,发生荧光猝灭:避免切片过度曝光。使用后立即将切片存放在黑暗中。
细胞/组织的过度固定:因为过度固定会使表位被遮蔽,使抗体无法与抗原结合,所以当然没有荧光。所以可以尽量减少固定时间,也可以尝试做抗原修复来揭示抗原表位。
组织/细胞干燥:确保切片在整个染色过程中保持湿润。
如果细胞没有透化,一抗就无法进入:例如,如果你要研究的目标蛋白在细胞内,但由于没有钻石,抗体无法进入细胞并与目标蛋白待在一起,那么你当然看不到它们。爱的火花。所以,我们可以想办法让细胞打开绿色通道,架起喜鹊之桥。例如,如果使用甲醛固定组织细胞,则可以使用 0.2% Triton X-100 对细胞进行透化(浓度可能因实验而异)。对于用甲醇或丙酮固定的组织细胞,不需要 Triton X-100,因为前者可以透化细胞。
一抗用量不足/孵育时间太短:增加抗体浓度或延长孵育时间
一抗不适合:在购买一抗之前,记得阅读产品信息,并不是所有的一抗都可以用于免疫荧光染色实验。另外,请确保产品尚未过期。
一抗和二抗不兼容:例如,如果您的组织来源是小鼠,那么一抗应该是某种动物抗小鼠,例如山羊抗小鼠,那么二抗应该是某种动物抗体山羊,如兔抗羊。也就是说,二抗应该针对一抗宿主。
切片保存时间过长:样本染色后应尽快观察拍照,否则信号会随着时间的推移而减弱。考虑将切片尽可能长时间地保存在 4⁰C 避光条件下。
抗体储存问题:避免反复冷冻和解冻抗体,因为这可能会导致抗体降解。建议购买抗体后,根据每次实验的需要,将抗体分成几小份保存,以便每次使用一小管。另外,存放前记得阅读使用说明书,并按照使用说明书的说明进行存放。比如具体的储存温度、是否避光等。