点击化学在生物医学中的应用
什么是点击化学和生物正交化学?
点击化学:一种基于杂原子连接(CXC)快速有效合成有用新分子的化学合成方法。 [1]
生物正交化学:利用点击化学原理在生命系统内部发生的化学反应,而不干扰天然生化过程。
2001年,对自然界最喜欢的分子的研究表明,与碳-碳键相比,分子更倾向于形成碳-杂原子键。 “点击化学”概念的灵感来自于核酸、蛋白质和多糖是通过碳-杂原子键结合在一起的缩合聚合物。点击化学是一种化学合成方法,可以快速有效地合成基于碳杂原子连接 (CXC) 的有用新分子。
在此之前,化学合成复杂、困难,但收率低。直到第一代点击化学,一价铜催化的叠氮化物-炔环加成(CuAAC)反应被提出,复杂的反应开始通过以图案化反应方式构建功能分子来简化。然而,铜催化剂的细胞毒性限制了CuAAC反应在体外和体内的应用。
此后,化学家发现了一种应变促进的炔烃-叠氮化物环加成(SPAAC)反应,该反应无需细胞毒性铜催化剂即可发生叠氮化物-炔烃反应。该反应已用于在体外和体内标记细胞表面的糖蛋白,没有明显的细胞毒性。
然而,一些化学家对SPAAC的二级反应速率常数并不满意。因此,布莱克曼等人。开发了s-四嗪和反式环辛烯 (TCO) 衍生物的环加成反应之间的逆电子需求狄尔斯-阿尔德 (iEDDA) 反应,可产生比 SPAAC 反应更快的无铜点击化学反应。

图2. 目前使用的点击化学反应的特点,来源:参考文献[3]
点击化学在生物医学中的应用
点击化学在生物医学研究领域取得了重要进展,特别是无铜点击化学,包括 SPAAC 和 iEDDA 反应。在体外研究中,点击化学可以对细胞靶蛋白进行特异性标记,并研究药物靶标与活细胞中药物替代物的相互作用。此外,细胞膜脂质和蛋白质可以在体外选择性标记,并且细胞可以通过点击化学连接在一起。在体内研究中,点击化学使分子成像和药物输送能够高效且有效地进行诊断和治疗。 [3]
接下来,我们介绍点击化学在生物医学研究中的几个具体应用。
用于荧光成像的点击化学
无铜点击化学最有趣的应用之一可能是细胞内感兴趣的目标 (TOI) 蛋白质的荧光成像。 [3]特别是在 iEDDA 反应中,可以使用 TCO-配体缀合物以及随后含有 Tz 的荧光团 (FLTz) 的处理成功地观察活细胞中的先天 TOI 蛋白。
例如,临床药物AZD2281与TCO结合开发了用于研究PARP1蛋白(已知是DNA修复的重要细胞蛋白)的生物探针。 TCO 与抗癌剂紫杉醇偶联,并使用紫杉醇-TCO/Tz-BODIPY FL 组合成功地实现了细胞内微管蛋白的可视化。后来的多配体-TCO 缀合物,如 BI2536、Foretinib、Dasatinib 和 Ibrutinib,也被用于开发靶向各种 TOI 蛋白,如 Polo 样激酶 1 (PLK1)、MET 和 BTK 蛋白。 [3]
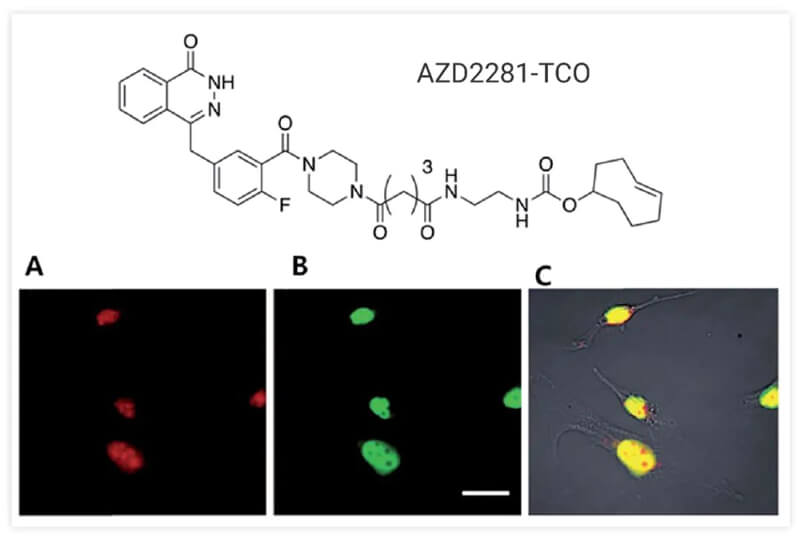
图 3. MDA-MB436 细胞中 AZD2281-TCO 和 Texas Red-Tz 之间的无铜点击反应。来源:参考文献[3]
靶向药物输送中的点击化学
点击化学已成为生物体研究中药物靶向递送的强大化学工具。点击化学的快速二阶反应速率常数、简单性和正交性可用于聚合物合成或药物载体开发过程中生物配体的位点特异性修饰。例如,2012 年,Koo 和 Lee 等人。提供证据表明体内点击化学可用于纳米颗粒递送。在该研究中,将负载 Ac4ManNAz 的纳米粒子对肿瘤细胞进行叠氮基标记,并使用含有光敏剂的 DBCO 修饰纳米粒子进行二次肿瘤靶向,依次注射到小鼠体内,叠氮基和 DBCO 之间的 SPAAC 增强了肿瘤靶向性。 [3]
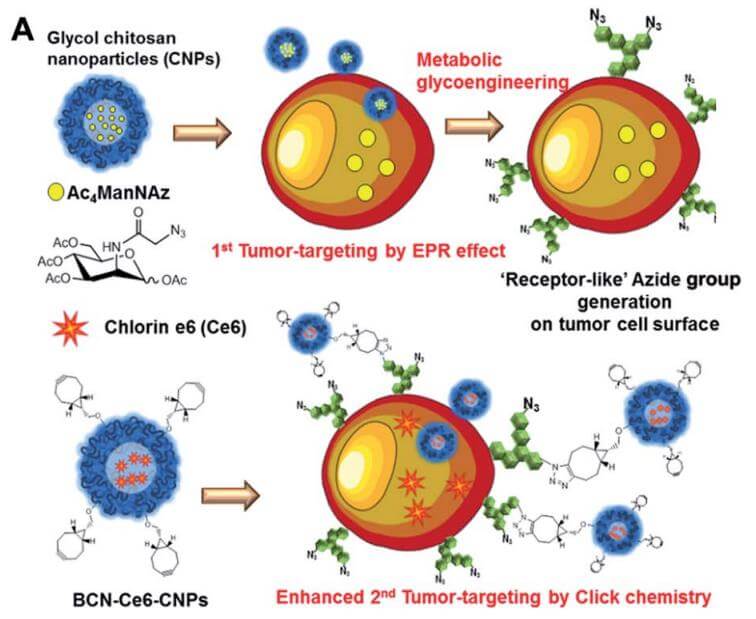
图 4. 点击化学在肿瘤靶向药物递送中的应用。来源:参考文献[3]
基于点击化学的 ADC 合成
Cu(I) 催化的炔烃叠氮环加成反应 (CuAAC) 在抗体药物偶联物 (ADC) 的合成中具有巨大潜力[4]。研究人员现已设计出高效且经济高效的基于 CuAAC 的 ADC 偶联方法,并证明可以快速合成 ADC,从而促进了 GlycoConnect 偶联技术的发展。 GlycoConnect 使用天然糖基化位点实现靶向缀合,并且可以在短短几天内将单克隆抗体转化为稳定的缀合 ADC。该技术基于两个过程:首先是酶促重塑(用叠氮化物进行修饰和标记),然后是基于无铜点击化学的有效负载连接。 Synaffix 已与多家公司合作开发其下一代 ADC 技术平台,其中包括 GlycoConnect。
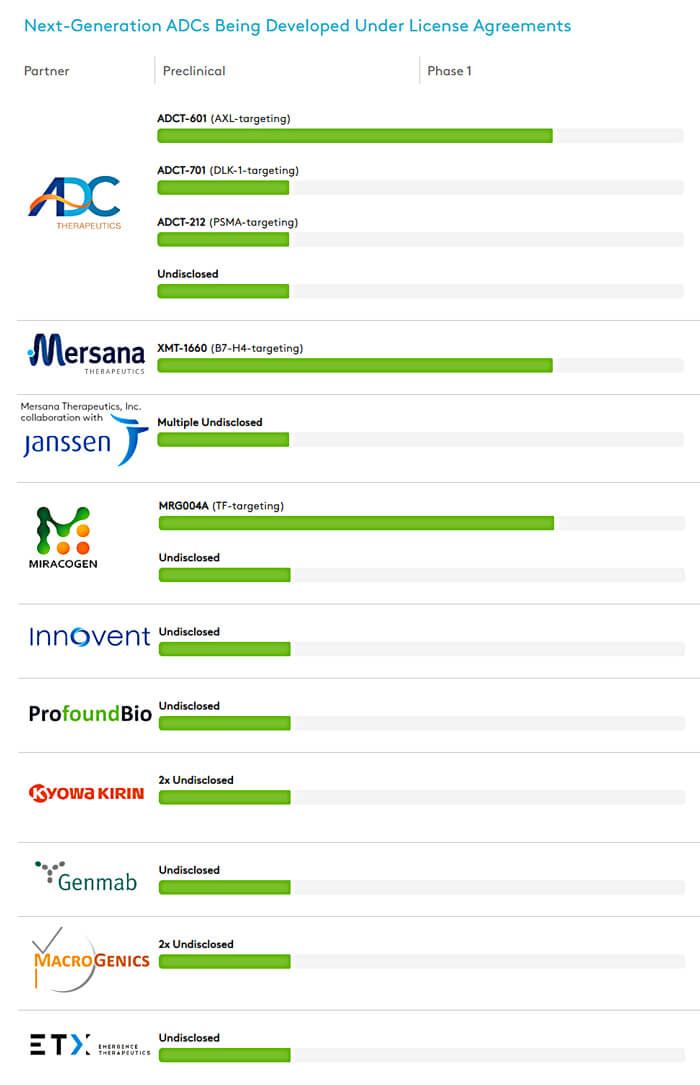
图 5. 根据许可协议开发的下一代 ADC
ADC Therapeutics 是较早获得 Synaffix ADC 平台技术的公司,也是目前使用该技术开发的产品数量最多的代表,其中ADCT-601已处于临床研究阶段。 [5] 目前,ADC Therapeutics 在实体瘤领域的公开产品 (3/5) 正在使用 Synaffix 的 ADC 技术。

图 6. ADC 治疗产品线
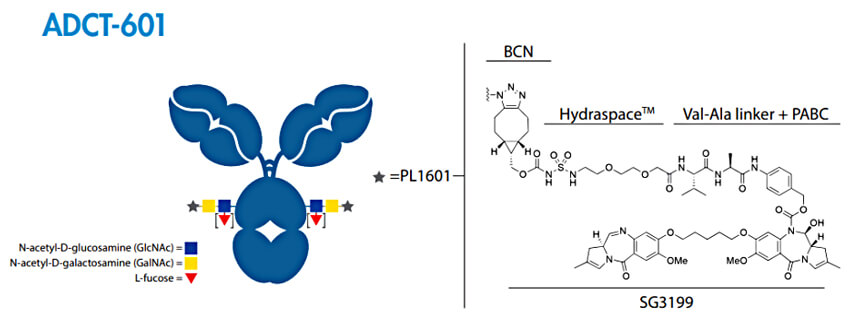
图 7. ADCT-601 的结构
基于点击化学的PROTAC合成
由于反应条件较温和且效率较高,点击化学常用于PROTAC分子的连接体中以连接分子的两端。瑞安·P·伍尔兹 (Ryan P Wurz) 等人展示了这种方法与溴结构域和末端结构域 4 (BRD4) 配体 JQ-1 (3) 以及针对 cereblon (CRBN) 和 Von Hippel–Lindau (VHL) 蛋白的连接酶结合剂的实用性 [6]。
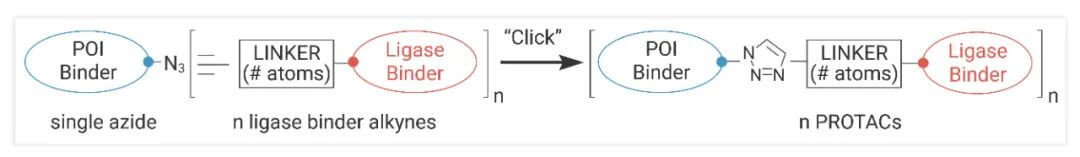
图8.基于Click Chemistry的PROTAC合成,来源:参考文献[6]
基于点击化学的诊断
点击化学还可用于开发用于了解组织发育、疾病诊断和治疗监测的分子工具。许多癌症将膜结合微泡 (MV) 释放到外周循环中,对胶质母细胞瘤 (GBM) 等 MV 进行分析是一种很有前景的疾病诊断方法。例如,李等人。报道了一种结合 iEDDA 型点击化学和小型微核磁共振 (μNMR) 的微流体系统,用于分析 GBM 患者血液中的 MV [4]。
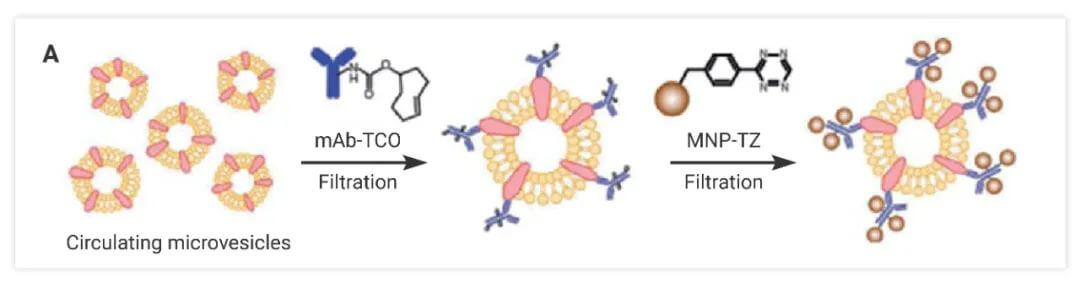
图 9. 单击“基于化学的诊断”。来源:参考文献[3]
概括
点击化学和非铜生物正交反应在生物医学研究领域取得了重要进展。点击化学可以对细胞靶蛋白进行特异性标记,并可用于将细胞粘附在一起,还可以实现高效且有效的分子成像和药物递送,以用于诊断和治疗目的。点击化学还可用于开发DNA纳米催化剂、基因组DNA化学合成、辅助CRISPR-Cas基因编辑、ADC和PROTAC合成等分子工具。总体而言,点击化学已成为生物医学领域和生物医学领域的重要工具。有机化学。
Biopharma PEG 作为全球点击化学试剂的供应商,自豪地培育了这种能量。我们提供用叠氮化物、炔烃、DBCO 和其他环辛炔功能化的 PEG 产品和试剂。