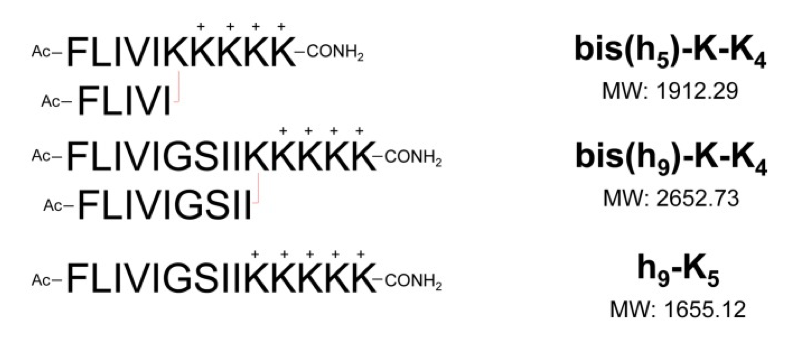构巢曲霉对支链两亲肽胶囊的摄取
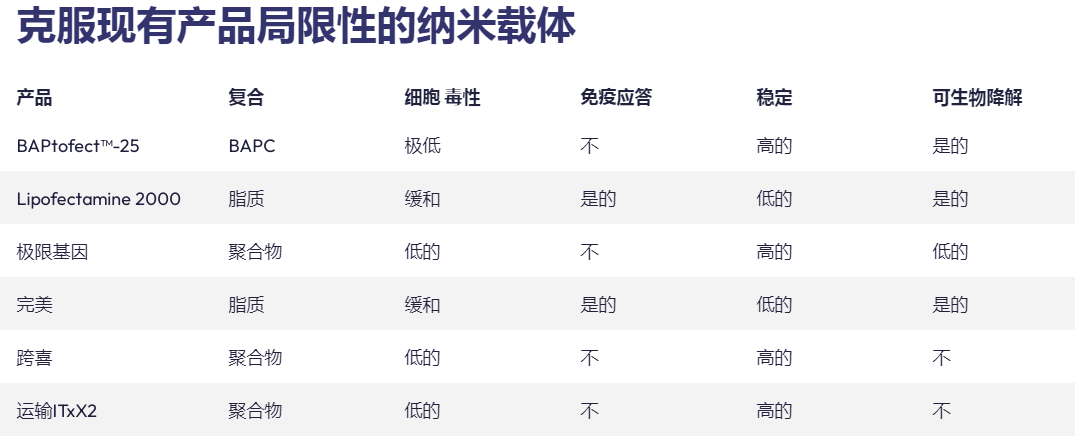
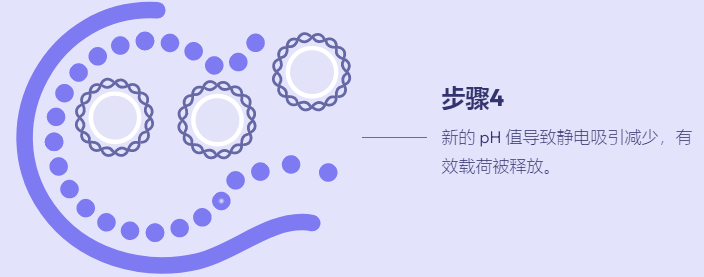
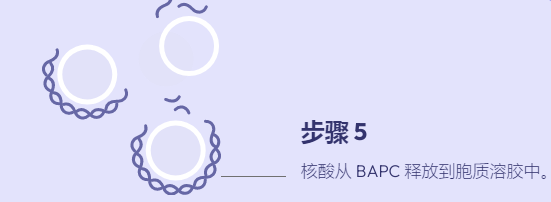
支链两亲肽胶囊 (BAPC) 将有效载荷封装和运输到细胞中的能力提供了递送活性成分 (AI) 的新方法。到目前为止,我们发现 BAPC 在之前测试过的真核细胞中是惰性的。然而,已收集到的照片表明,构巢曲霉(一种常见的土壤真菌)表现出细胞内摄取并随后分解 BAPC 纳米颗粒,从而在真菌细胞内释放包封的染料。

图 1. BAPC 在构巢曲霉中分解,在真菌细胞内释放封装的染料。
实验旨在优化杀真菌剂向该真菌物种的递送。在后续实验中,观察到 BAPC 可以包裹和递送杀菌剂硫脲。当发现在曲霉菌扩散的牛奶平板上时,包封 BAPC 的硫脲显示出清晰的抑菌圈。在将真菌暴露于含有 AI 的 BAPC 后,硫脲存在于液体培养物的分离培养基中。该结果表明不仅 BAPC 被打开,而且真菌能够分泌 BAPC 降解蛋白酶。这也说明普通土壤真菌会降解 BAPC,表明它们不会在环境中积累。