第三回 富士胶片和光纯药助力利用细胞外囊泡的治疗方法的实现
干细胞来源EV ~治疗,诊断,化妆品的开发~
![]()
富士胶片和光纯药株式会社 生产工序开发部 西部隆宏
◆前言
细胞外囊泡(Extracellular vesicle/EV)是由细胞分泌的具有磷脂双分子层结构的微小囊泡的总称,包括外泌体和微囊泡等1)。近年来,部分细胞(如间充质干细胞 [Mesenchymal stem cell : MSC] 等)来源的EV已被证明在疾病治疗方面发挥作用2),由此促进了使用EV的治疗用试剂、与EV制剂的应用相关的技术开发。
本文将介绍富士胶片和光纯药提供的,参与EV的生成、提纯、保存、质量管理等一系列生成工序的技术以及产品。
◆使用MSC来源EV生成的优化培养基
近年来,我们对各种细胞来源EV的治疗应用进行了尝试,其中MSC来源EV的研究开发尤其受瞩目。事实上截至2022年,在利用EV进行的临床试验中就有六成以上使用了MSC来源EV3)。另一方面,为了获得MSC来源EV而使用的培养液大部分都是传统的基本培养基,优化的培养条件目前尚未确定。
MSC来源EV的生成中大多使用两步工序:在血清培养基(含有牛胎儿血清(FBS)的基本培养基)中增殖MSC后,更换成不含FBS的血清培养基或已去除EV但含有FBS的血清培养基,使EV在培养上清液中生成。敝司针对上述的各阶段工序分别开发了优化培养基。
在MSC的增殖环节,敝司开发了能够使MSC在高品质的状态下高效进行增殖的培养基:MSCulture™(产品编号:133-19331、132-19345)。本培养基是添加了FBS的基本培养基,但与αMEM等传统基本培养基相比细胞增殖效率更高。另外也确认到增殖后的MSC生成的EV的生物活性也得到了提高(图1)。
另外,敝司也开发了用于MSC增殖后生成EV这一阶段的EV生成专用无血清培养基:EV-Up™(产品编号:053-09451、298-84001)。本培养基不仅能提高EV的生成量,还能通过抗纤维化活性确认到生物活性大幅上升4)(图2)。
通过组合使用MSCulture™培养基与EV-Up™培养基,可高效获得高品质的MSC来源EV。在以MSC来源EV的治疗应用为目的进行研究时,请务必考虑使用上述两款培养基。
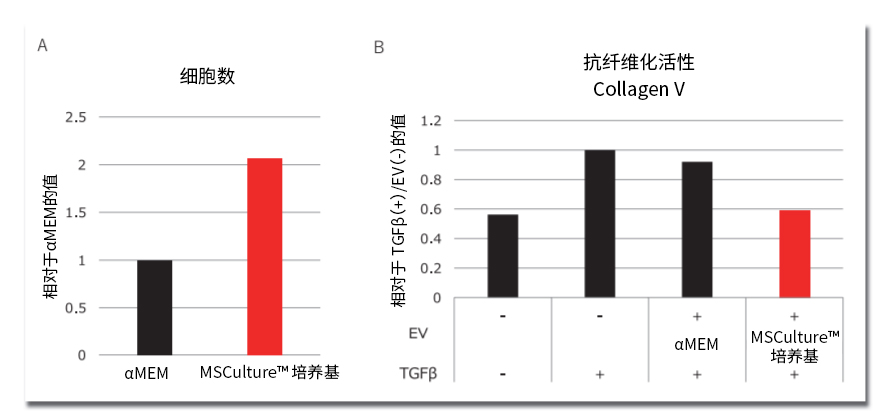
图1. MSCulture™培养基中MSC的增殖能力上升与获得的EV的生物活性之间的对比结果
A)αMEM及MSCulture™培养基中MSC增殖时的细胞数对比
A)αMEM及MSCulture™培养基中各添加了15%的FBS进行测试
B)在各培养基中增殖MSC,从其中获得EV并使用EV-Up™培养基比较它们的抗纤维化活性

图2. 评估EV-Up™培养基中MSC来源EV的生成量和生物活性的结果
A)MSC在血清培养基中扩大培养后,培养基更换为去除EV、含FBS的DMEM或EV-Up™培养基。
A)对获得的培养上清液中提取的外泌体粒子数进行纳米粒子追踪分析后的检测结果
B)在抗纤维化评估中比较从A的各条件中获得的EV的生物活性的结果
◆特有的EV纯化技术、使用PS亲和法的EV纯化技术
敝司与现金泽大学医学部的華山教授合作,研究可应用于从EV生成后的培养上清中纯化EV的工序的技术,开发出了特有的EV纯化方法——PS亲和法5)。使用了本技术的研究用EV纯化试剂MagCapture™ Exosome Isolation Kit PS Ver. 2(产品编号:290-84103)现已上市。
PS亲和法是使用了与磷脂酰丝氨酸(Phosphatidylserine : PS)特异性结合的T 细胞免疫球蛋白结构域和含有粘蛋白结构域的蛋白4(T-cell immunoglobulin domain and mucin domain-containing protein 4, 简称Tim4)亲和纯化方法,同时作为一种优秀的纯化方法,它在MSC来源EV培养上清液中的回收率约有80%。已确认在in vitro的抗纤维化活性评估、抗炎症活性评估中,通过PS亲和法纯化的EV表现出优秀的生物活性6)(图3)。为了能够将此PS亲和法应用于EV制剂的生成,我们目前正在开发一种使用固定化Tim4蛋白质亲和柱的大规模纯化技术,公升级规模的培养上清液中的EV的亲和柱纯化将指日可待。
◆提高纯化后EV的保存稳定性的技术
由于纯化后的EV会吸附在管壁上,因此在处理时一般倾向于添加能够抑制EV的非特异性吸附的成分。我们向来非常重视EV的非特异性吸附这一问题,在处理EV时我们也推荐使用吸附抑制试剂——EV-Save™细胞外囊泡保存稳定剂 (产品编号:058-09261) 。经确认,此EV-Save™细胞外囊泡保存稳定剂不仅能抑制EV的吸附,还能使EV在冷冻保存时的稳定性得到提高(图4)。敝司十分重视提高EV制剂在生成时的EV吸附抑制和冷冻保存时的稳定性,为此开发了仅由已被用作医疗药品添加剂的成分组成的EV保存液(in vivo用EV-Save™ 细胞外囊泡保存稳定剂,产品编号:050-09461;图4)。目前本产品作为用于in vivo实验的研究用试剂进行销售,而由于使用了旨在用于医疗领域的成分,所以也十分推荐将其利用于EV制剂的研究开发。
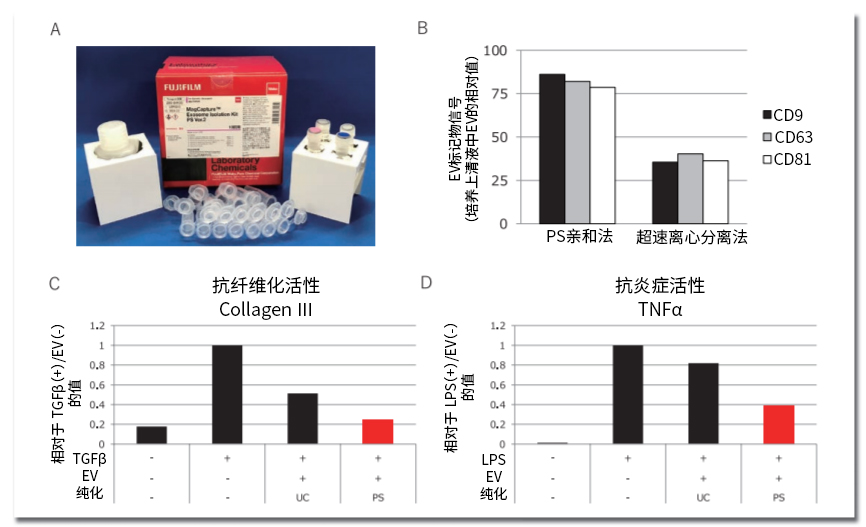
图3. 使用PS亲和法进行MSC来源EV的纯化
A)基于PS亲和法的EV纯化研究用试剂 MagCapture™ Exosome Isolation Kit PS Ver. 2。
B)PS亲和法、超速离心分离法分别纯化MSC来源EV后,使用ELISA对其回收率进行定量的结果。分别使用抗CD9抗体、抗CD63抗体、抗CD81抗体检
B)测。图表为与培养上清液中的EV标记量的相对值。
B)使用的ELISA为PS Capture™ Exosome ELISA Kit(Streptavidin HRP)(产品编号:298-80601)。
C)定量PCR分析MSC来源EV对抑制TGFβ刺激纤维芽细胞诱导的纤维化相关基因表达上升的结果。
D)定量PCR分析MSC来源EV对抑制LPS刺激PBMC来源单核细胞诱导的炎症相关基因表达上升的结果。
UC:超速离心分离法;PS:PS亲和法
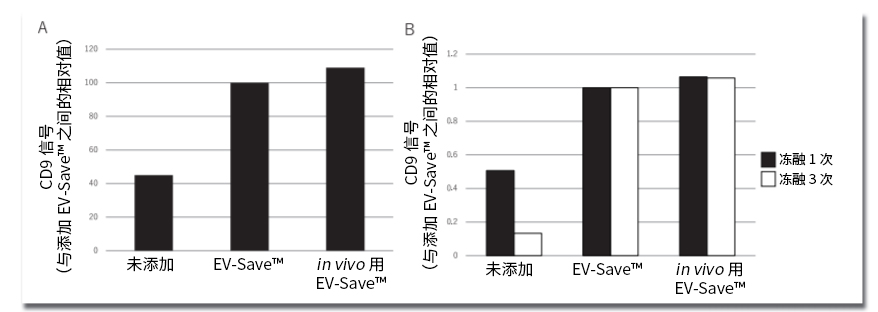
图4. 评估保存在样品管中的EV吸附损失的结果
A)向使用PS亲和法纯化的COLO201细胞来源EV中添加EV-Save™和in vivo用EV-Save™,冷冻保存16小时后,使用PS Capture™ Exosome ELISA Kit
A)(Streptavidin HRP)检测样品管内的EV标记物量的结果。
B)将添加了EV-Save™和in vivo用EV-Save™的COLO201细胞来源EV融冻1或3次,之后使用PS Capture™Exosome ELISA Kit(Streptavidin HRP)检
B)测样品管内的EV标记物量的结果。
◆可应用于EV的生产过程管理和质量管理的ELISA技术
在EV的治疗应用中,重要的不仅是EV的生产技术,还有质量管理技术的确立。其中,能够定性定量地分析EV标记物的技术在评估EV的质和量上也同样举足轻重。敝司开发了能够定性·定量分析EV标记物的ELISA产品,并以试剂盒的形式上市。使用针对EV标记物(CD9、CD63、CD81等)抗体的CD-Capture系列三明治法ELISA试剂盒,或是使用固定了Tim4的平板捕获EV后用针对任意EV标记物的抗体进行检测的PS Capture ELISA,都能够以符合目标的模式进行检测。以上方法在敝司的技术开发中也是十分有用的工具(用于图3 B、图4中的实验),因此也十分推荐将上述试剂盒用于EV生产过程中的监测和纯化EV的质量管理等方面。
◆结语
以MSC来源EV为中心的EV的治疗应用正备受期待,因此EV的制造技术和评估技术的优化和标准化也成为了一大课题。敝司至今将有关EV生成的一系列工序的技术以研究用试剂的形式推出上市,而今后将促进产品适配EV制剂的实际生产与质量管理部分,为实现EV治疗这一全新的疗法做出贡献。
◆参考文献
1) Colombo, M. et al . : Annu. Rev. Cell Dev. Biol., 30, 255 (2014).
2) Phinney, D. G. and Pittenger, M. F. : Stem Cells, 35 (4), 851 (2017).
3) Rezaie, J. et al. : Cell Commun. Signal., 20(1), 145 (2022).
4) 丸谷祐樹、山根昌之 : 和光純薬時報, 89 (4), 8 (2021).
5) Nakai, W. et al. : Sci. Rep., 6, 33935 (2016).
6) 山根昌之、石止貴将 : 和光純薬時報, 88 (4), 10 (2020).
点击此处查看更多外泌体系列产品技术和应用文章
点击此处查看更多外泌体系列产品
