病毒载体技术的进步提高了基因和细胞治疗的安全性和有效性,全球已有多种基因和细胞治疗药物被监管机构批准上市。目前大多数基因/细胞治疗方法都是利用病毒载体来实现的,其中最常用的两种病毒载体——腺相关病毒(AAV)载体常被用于基因治疗,而慢病毒(LV)载体则常被用于基因修饰的细胞治疗。病毒载体通常是将2-4个质粒共转入HEK293细胞生产出的,而转染试剂是病毒载体生产的关键要素之一,对转染效率和功能效价有显著影响。第一代非病毒转染方法依靠简单的线性聚合物,如聚乙烯亚胺(PEI)或脂质体将DNA转入到细胞内,但其性能并不能完全满足病毒载体的大规模生产需求。虽然人工合成转染试剂在过去30年里取得了巨大的进步,但仍然难以逾越大自然在数十亿年进化出的依靠病毒传递基因的效率。因此,优化非病毒转染性能的最佳方法是尽可能模仿出病毒转运DNA的自然机制的试剂。
上海金畔生物科技有限公司代理的Mirus转染试剂就是利用自然基因传递机制作为其化合物库的设计灵感,从中筛选出适合病毒生产的混合配方,将转染试剂与核酸的静电相互作用、细胞吸附与内吞、胞内释放、基因表达效率和降低细胞毒性等几乎所有影响转染成功率的因素全部考虑在内。通过不懈的努力,Mirus开发出了一种全新的仿生转染技术——TransIT-VirusGEN系列转染试剂,它不仅仅是基于PEI或脂质体,而是采用多组分脂质聚合物纳米复合物(LPNC),能够高效地结合和包裹DNA,将其带入悬浮或贴壁的HEK293细胞中,然后将其从细胞核内释放,以便同时满足2-4个不同的质粒的表达,这种全新的转染试剂比单独使用PEI及其衍生聚合物或脂质体的转染效率和完整病毒生产效率都有显著提高。同时,Mirus还研发出了一种完全合成的(无动物源)转染增强剂(Enhancer),与TransIT-VirusGEN转染试剂搭配使用时,可以进一步提高病毒滴度。另外,为了满足病毒载体从研发到大规模生产不同阶段的需求,Mirus分别推出了R&D、SELECT和GMP三种级别的TransIT-VirusGEN转染系列产品,以适应不同阶段病毒载体的生产规模、效率以及法规要求。
实验表明,Mirus基于LPNC的转染试剂可以在不同的细胞培养平台(贴壁和悬浮)、生物反应器和培养基类型中提高病毒产量和功能性病毒滴度。与业内其他金标准相比,在不使用增强剂的情况下,病毒滴度至少可提高2-4倍。而在加入增强剂之后,在合适的培养条件下,病毒产量甚至能够提高10倍以上!(结果见下图1-5)
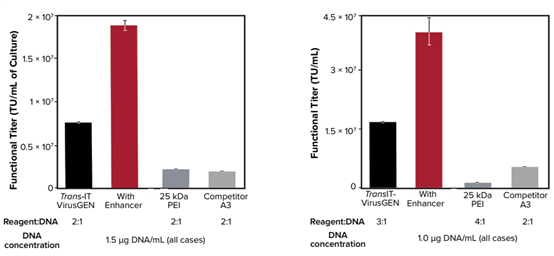
图1. 基于脂质聚合物纳米复合物(LPNC)和聚乙烯亚胺(PEI)配方的转染试剂用于腺相关病毒(AAV)和慢病毒(LV)载体生产的性能对比。分别用基于LNPC的TransIT-VirusGEN试剂(不含增强剂与含增强剂)、25kda PEI和基于PEI技术的竞争品牌A3转染试剂产生AAV(左)和LV(右)。以LPNC为基础的TransIT-VirusGEN转染试剂比以PEI为基础的转染试剂的病毒颗粒表达量高3-5倍。当TransIT-VirusGEN和增强剂同时使用时,比单独使用TransIT-VirusGEN大约提升了一倍。转染试剂 : DNA的比值为体积 : 质量。
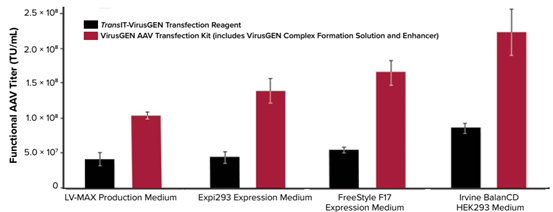
图2. TransIT-VirusGEN转染试剂在不同细胞培养基中的表现。使用Thermo Fisher Scientific公司的病毒生产细胞进行转染,该细胞适应四种不同的培养基配方,分别来自Thermo Fisher公司的LV-MAX培养基、Expi293表达培养基、FreeStyle F17表达培养基和来自Irvine Scientific公司的BalanCD HEK293培养基。后一种培养基的AAV总效价较高,但在所有使用的培养基中,无论是否添加增强剂,TransIT-VirusGEN转染试剂均表现优异。DNA与转染试剂配比为2μg DNA :3μl转染试剂,转染细胞密度为2.0×106个/ml。生产LV也获得了类似的结果(数据未显示)。
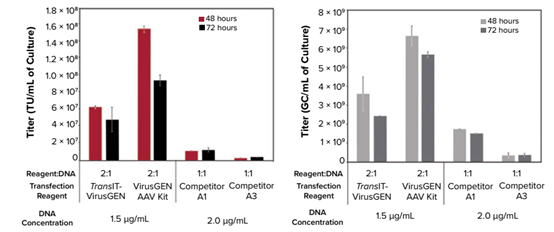
图3. 分别在四种不同的转染条件和两个不同的收获时间,测定TransIT-VirusGEN转染试剂和PEI为基础的转染试剂A3的物理滴度和功能滴度。利用Expi293F细胞生产AAV2-GFP。转染48小时和72小时后收获的病毒分别测定功能滴度TU/mL(左)和物理滴度GC/mL(右)。结果显示用TransIT-VirusGEN转染试剂和增强剂转染收获的病毒效价最高。此外,TransIT-VirusGEN转染试剂比PEI为基础的转染试剂的表达更快。这些结果表明,对于病毒滴度的评估,功能滴度可能是一个更可靠的指标。因此,建议测试几个不同的收获时间点来确定最佳方案。
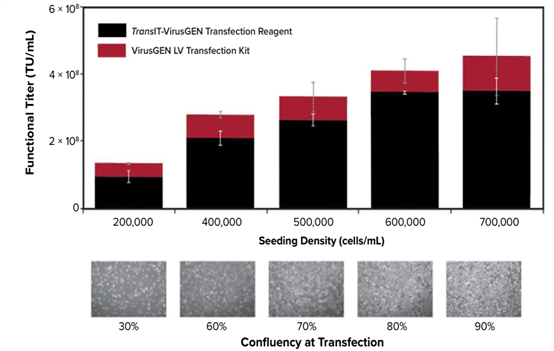
图4. 每种培养体系都应优化转染时的细胞融合度和接种密度。用DMSO+10%胎牛血清培养贴壁的HEK293t/17细胞生产慢病毒(1μg DNA/mL)。试剂盒包括TransIT-VirusGEN转染试剂、VirusGEN LV复合物形成溶液和VirusGEN LV增强剂。

图5. 在Expi293表达培养基中培养Expi293F细胞,使用VirusGEN AAV转染试剂盒,内含TransIT-VirusGEN转染试剂、VirusGEN AAV复合物形成溶液和VirusGEN AAV增强剂,在悬浮细胞培养中生产AAV。分别用2:1(左)和3:1(右)两种比例来确定理想的转染试剂和DNA配比(体积:质量)。每种转染体系都应对转染试剂: DNA配比及每毫升细胞所需的总DNA量进行优化。
TransIT-VirusGEN转染系列产品信息


美国Mirus公司成立于1995年,是世界上很早开发高效、低毒转染试剂的公司之一,同时也是目前该类试剂主要的供应商之一。Mirus被公认为转染试剂开发的领跑者,其许多杰出成果获得世界公认与广大用户的好评。
上海金畔生物科技有限公司是Mirus中国区代理,始终秉承着专业、严谨的态度为客户提供优质的产品与服务。如果您对上述产品感兴趣,欢迎致电上海金畔客服热线021-50837765或登录网站www.jinpanbio.cn了解更多产品信息或申请试用。
引用文献:
Addressing Critical Issues in Cell & Gene Therapy, Snow, J.
(https://www.mirusbio.com/assets/technical-documents/addressing-critical-issues-in-cell-gene-therapy.pdf)
